Kimyasal Türler Arası Etkileşimler Nelerdir ?

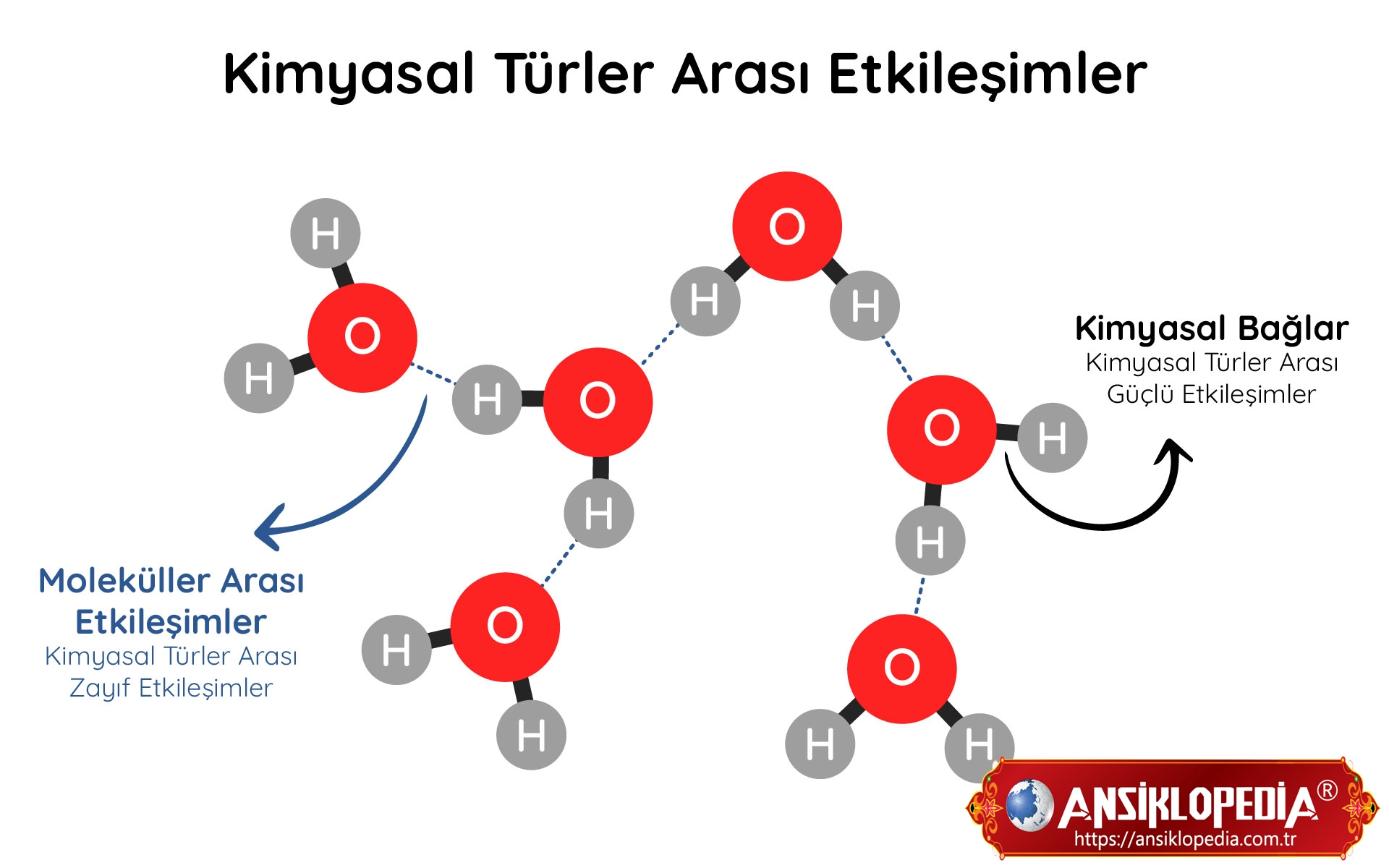
Kimyasal türler arası etkileşimler, atomlar, moleküller, iyonlar ve atom grupları arasında gerçekleşen etkileşimlerdir. Bu etkileşimler, maddenin yapısını, özelliklerini ve davranışını etkiler.
Kimyasal türler arası etkileşimler, iki ana gruba ayrılır:
- Güçlü etkileşimler: Kimyasal bağları oluşturan etkileşimlerdir. İyonik bağ, kovalent bağ ve metalik bağ, güçlü etkileşimlere örnektir.
- Zayıf etkileşimler: Kimyasal bağları oluşturmaz. Moleküller arası etkileşimler olarak da bilinir. Dipol-dipol etkileşimi, hidrojen bağı ve London kuvvetleri, zayıf etkileşimlere örnektir.
Güçlü etkileşimler:
-
İyonik bağ: İki atom arasındaki elektron alışverişine dayanır. Sonuçta eksi yüklü bir iyon olan anyon ve artı yüklü bir iyon olan katyon oluşur. İyonik bağ, genellikle metaller ve ametaller arasında görülür. Örneğin, NaCl (sodyum klorür) bileşiminde, sodyum atomu bir elektronunu klor atomuna verir. Sodyum atomu, bir elektron kaybettiği için katyon (Na+) olur. Klor atomu ise bir elektron aldığı için anyon (Cl-) olur. Bu iki iyon, elektrostatik çekim kuvveti ile bir arada tutulur.
-
Kovalent bağ: İki atom arasındaki elektron ortaklaşmasına dayanır. Sonuçta, her iki atom da ortak elektron çiftine sahiptir. Kovalent bağ, genellikle ametaller arasında görülür. Örneğin, H2 (hidrojen) bileşiminde, iki hidrojen atomu, bir elektron çiftini ortaklaşa kullanır. Bu ortak elektron çifti, iki hidrojen atomunu bir arada tutar.
-
Metalik bağ: Metal atomları arasındaki elektron denizi ile oluşur. Metal atomları, elektronlarını kolayca verebilir. Bu elektronlar, metal atomlarının oluşturduğu bir elektron denizinde serbestçe dolaşır. Metalik bağ, genellikle metaller arasında görülür. Örneğin, Fe (demir) bileşiminde, demir atomları, elektronlarını bir elektron denizi oluşturmak için ortaklaşa kullanır. Bu elektron denizinde serbestçe dolaşan elektronlar, demir atomlarını bir arada tutar.
Zayıf etkileşimler:
-
Dipol-dipol etkileşimi: Polar moleküller arasında görülür. Polar moleküller, pozitif ve negatif yük merkezlerine sahiptir. Bu yük merkezleri arasındaki elektrostatik çekim kuvveti, dipol-dipol etkileşimini oluşturur. Örneğin, H2O (su) molekülü, polar bir moleküldür. Su molekülünün oksijen ucunda negatif bir yük merkezi, hidrojen uçlarında ise pozitif bir yük merkezi bulunur. Bu yük merkezleri arasındaki elektrostatik çekim kuvveti, su moleküllerini bir arada tutar.
-
Hidrojen bağı: Bir hidrojen atomu ile bir elektronegatif atom arasındaki güçlü bir dipol-dipol etkileşimidir. Hidrojen bağı, genellikle su ve organik bileşiklerde görülür. Örneğin, H2O (su) molekülünde, hidrojen atomları, oksijen atomundaki elektronları çeker. Bu çekme sonucu, hidrojen atomlarının kısmi pozitif, oksijen atomunun ise kısmi negatif yüklenmesi olur. Bu yüklenme, hidrojen atomları ile oksijen atomları arasında güçlü bir dipol-dipol etkileşimini oluşturur.
-
London kuvvetleri: Tüm moleküller arasında görülen, en zayıf etkileşim türüdür. London kuvvetleri, moleküllerin geçici ve rastgele olarak oluşan kutuplanmalarına dayanır. Kutuplanmış moleküller arasındaki elektrostatik çekim kuvveti, London kuvvetlerini oluşturur. Örneğin, O2 (oksijen) molekülü, apolar bir moleküldür. Ancak, oksijen atomlarının elektronları, molekülün farklı yerlerinde yoğunlaşabilir. Bu durumda, molekül geçici olarak kutuplu hale gelir. Kutuplanmış oksijen molekülleri arasındaki elektrostatik çekim kuvveti, London kuvvetlerini oluşturur.
Kimyasal türler arası etkileşimler, maddenin yapısını, özelliklerini ve davranışını etkiler. Örneğin, güçlü etkileşimler, maddelerin fiziksel özelliklerini etkiler. Örneğin, iyonik bileşikler, yüksek erime ve kaynama noktalarına sahiptir. Zayıf etkileşimler ise, maddelerin kimyasal özelliklerini etkiler. Örneğin, zayıf etkileşimler, maddelerin çözünürlüğünü etkiler.
-
0 Yorum
-
10 Görüntülenme